Transfekce - jakou metodu vybrat?
Naše nejprodávanější transfekční činidla
Co je to transfekce, jak funguje a srovnání transfekčních činidel Promega a konkurence se dočtete níže v článku.
| Název produktu | Kód zboží | |
| E2691 |  |
|
| E2311 |  |
|
| E4981 |  |
|
| E5911 |  |
Kompletní nabídka transfekčních činidel v e-shopu
Transfekce
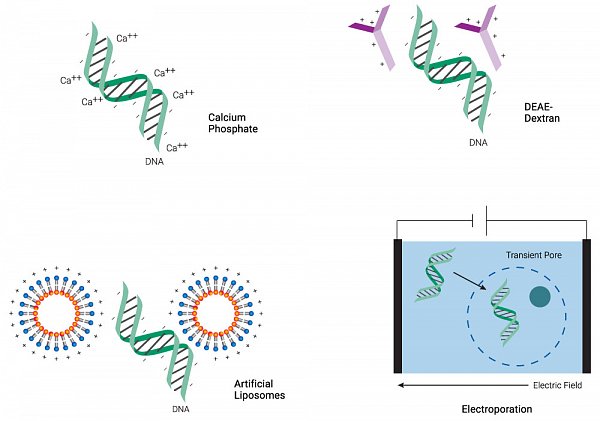
Transfekce je proces, při kterém se dopravuje cizorodá nukleová kyselina do cytoplazmy nebo jádra eukaryotických buněk. Tato technologie přenosu genů umožňuje studium funkce genů, proteinové exprese, proteinových interakcí, modifikaci genomu pomocí CRISPR-Cas9 aj. V závislosti na konkrétní aplikaci a typu buněk může být transfekce větší či menší výzvou, a proto bylo vyvinuto několik základních metod, jak nukleové kyseliny do buněk dostat při současném zachování jejich viability. Tyto metody se dají rozdělit na tři základní skupiny – virální, chemické a fyzikální. Úhlavními nepřáteli při transfekci jsou obranné mechanismy buněk, které rychle štěpí cizorodou DNA a RNA. V případě, že transfekční metoda přenáší externí nukleovou kyselinu pouze do cytoplazmy (např. lipofekce, elektroporace), závisí úspěch transfekce na tom, jestli proběhne v krátkém časovém intervalu mitóza. Pouze tehdy totiž dochází k rozvolnění jaderné membrány a exogenní DNA má možnost vstoupit do jádra. V opačném případě dochází k rychlé degradaci DNA a neúspěšné transfekci. Tento problém je nejvýraznější u primárních buněk, které se dělí velmi pomalu nebo vůbec (např. neurony). Pokud je metoda schopná doručit DNA přímo do jádra (nukleofekce, virální vektory, mikroinjekce), mitóza pro úspěch není nutná a lze transfekovat i pomalu se dělící a nedělící buňky. V dalších odstavcích si blíže popíšeme jednotlivé metody spolu s jejich výhodami a nevýhodami.
Virální transfekce
Virální vektory doručují DNA a RNA do buněk pomocí procesu tzv. transdukce. Tento proces zahrnuje nejprve zabalení nukleové kyseliny do virálních částic, ty jsou pak namnoženy pomocí vybraných buněčných linií (např. HEK293T), izolovány a přidány k buňkám, které chceme transfekovat. Virální vektory jsou velmi efektivní, jsou schopny doručit DNA přímo do jádra a lze je použít pro mnoho typů buněk. Jejich hlavní nevýhodou je ale časově náročná a pracná příprava virálních částic, některé viry navíc vyžadují dodatečné bezpečnostní opatření v laboratoři. Nejčastěji používanými typy virů jsou lentiviry, adenoviry, adeno-asociované viry (AAV) a herpes viry. AAV jsou nejčastěji používané pro editaci genomu pomocí CRISPR, protože jsou relativně bezpečné, jejich DNA se z většiny neintegruje do genomu buněk a nehrozí tak náhodné porušení funkce životně důležitých genů. Nevýhodou je, že horní limit velikosti transfekované DNA je asi 4,5 kb, což může být limitujícím faktorem pro některé aplikace.
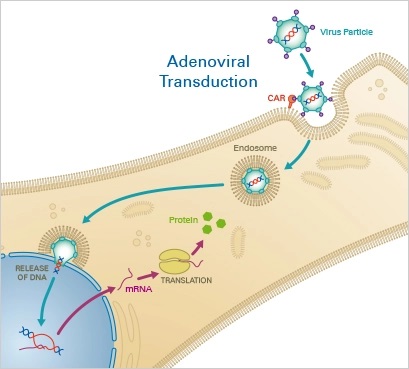 Obr. 1 Schéma transfekce buněk pomocí virálního vektoru
Obr. 1 Schéma transfekce buněk pomocí virálního vektoru
Chemické metody
Mezi chemické metody patří zejména lipofekce, která využívá kationtové lipidy tvořící komplex se záporně nabitými nukleovými kyselinami. DNA nebo RNA se při lipofekci uzavře do lipozomů, které pak fúzují s cytoplazmatickou membránou a vylijí svůj obsah do cytoplazmy. Hlavní výhody lipofekce jsou zejména jednoduchost, nízká cena, nízká toxicita pro buňky a možnost použití i pro high-throughput experimenty. Na druhou stranu má tato metoda o něco nižší účinnost, která se ale s novými generacemi transfekčních činidel stále zvyšuje. Při lipofekci se také DNA nedostává přímo do jádra buněk a úspěšnost transfekce je tak závislá na jejich dělení. Mezi stálice na poli lipofekce patří jednoznačně transfekční činidla Fugene 6, Fugene HD a Viafect od firmy Promega, o čemž svědčí vysoký počet publikací, ve kterých byla použita. Všechna tři činidla nabízí široké možnosti použití, vysokou účinnost a nízkou toxicitu pro buňky. Fugene 6 je nejstarší formulací a poskytuje robustní výsledky při transfekci běžně používaných buněčných linií. Fugene HD je novější formulací a je vhodný i pro náročnější buňky jako jsou rozličné rakovinné linie, kmenové buňky nebo hmyzí buňky a je použitelný i pro produkci virů a proteinů. Viafect je novějším činidlem, které díky vylepšenému složení poskytuje srovnatelné nebo lepší výsledky než Fugene, a to s ještě nižší toxicitou pro buňky. Nejnovějším příspěvkem do rodiny je pak Fugene 4K, který byl vyvinut společností Promega jako odpověď na Lipofectamine 3000. U většiny buněk poskytuje lepší výsledky a zároveň i vyšší viabilitu po transfekci než konkurence. Díky vyšší účinnosti lze použít i pro transfekci náročnějších linií.
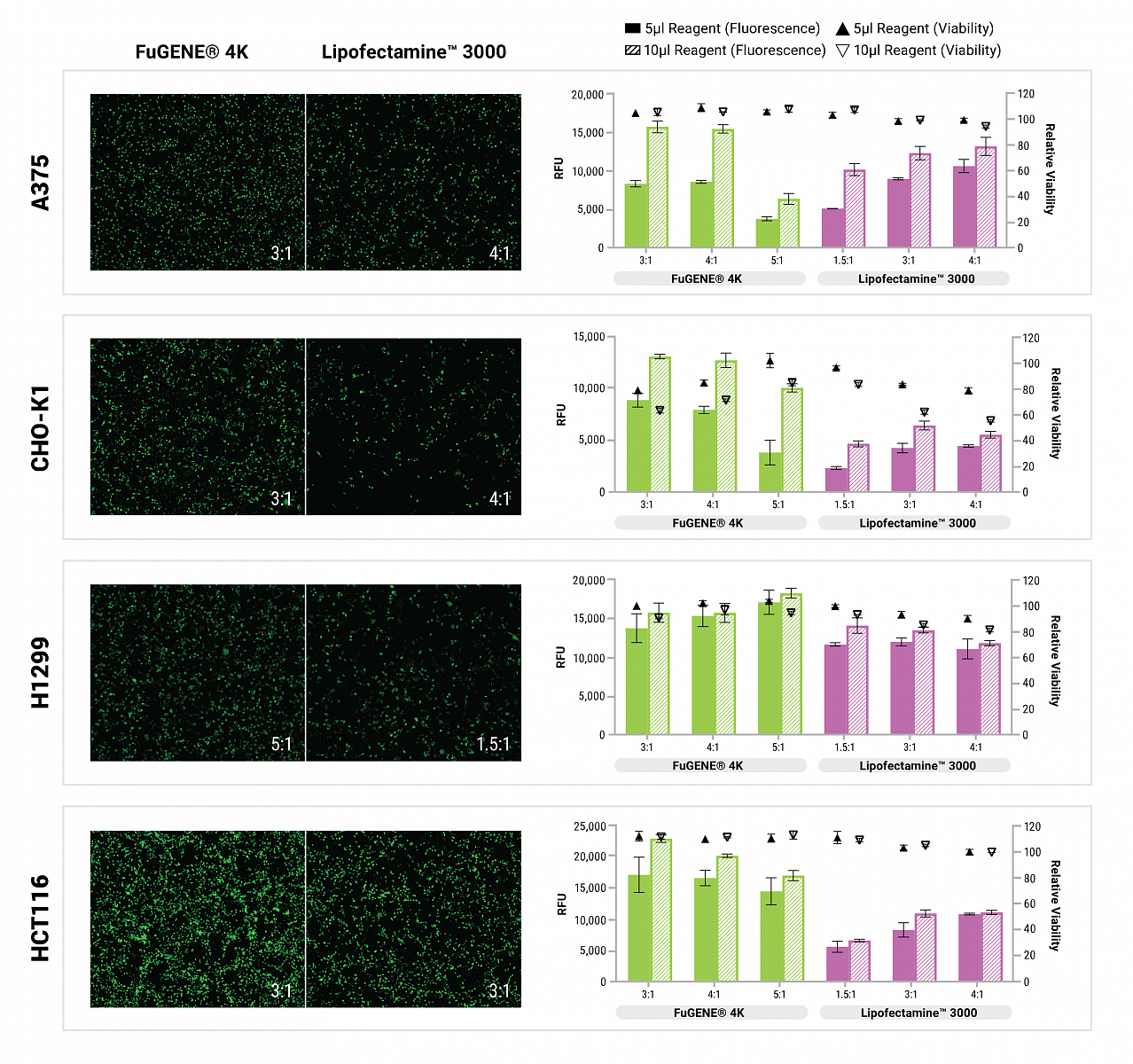
Obr. 2 Srovnání transfekční účinnosti a viability buněk po transfekci různých buněčných linií činidly Fugene 4K a Lipofectamine 3000.
Protokol při transfekci všemi čtyřmi činidly je velmi jednoduchý. Stačí smíchat transfekovanou DNA s činidlem a po krátké inkubaci přidat vzniklé lipozomy přímo k buňkám v růstovém médiu. Srovnání jednotlivých reagentů pro běžně používané buněčné linie je uvedeno v Tabulce. Pro běžně používané buněčné linie jsou na stránkách Promegy navíc dostupné optimalizované protokoly, které vám značně zjednoduší zavedení metody do vaší laboratoře. Vždy je samozřejmě potřeba hlídat i další parametry transfekce jako je kvalita vstupní DNA, číslo pasáže a konfluence vašich buněk.
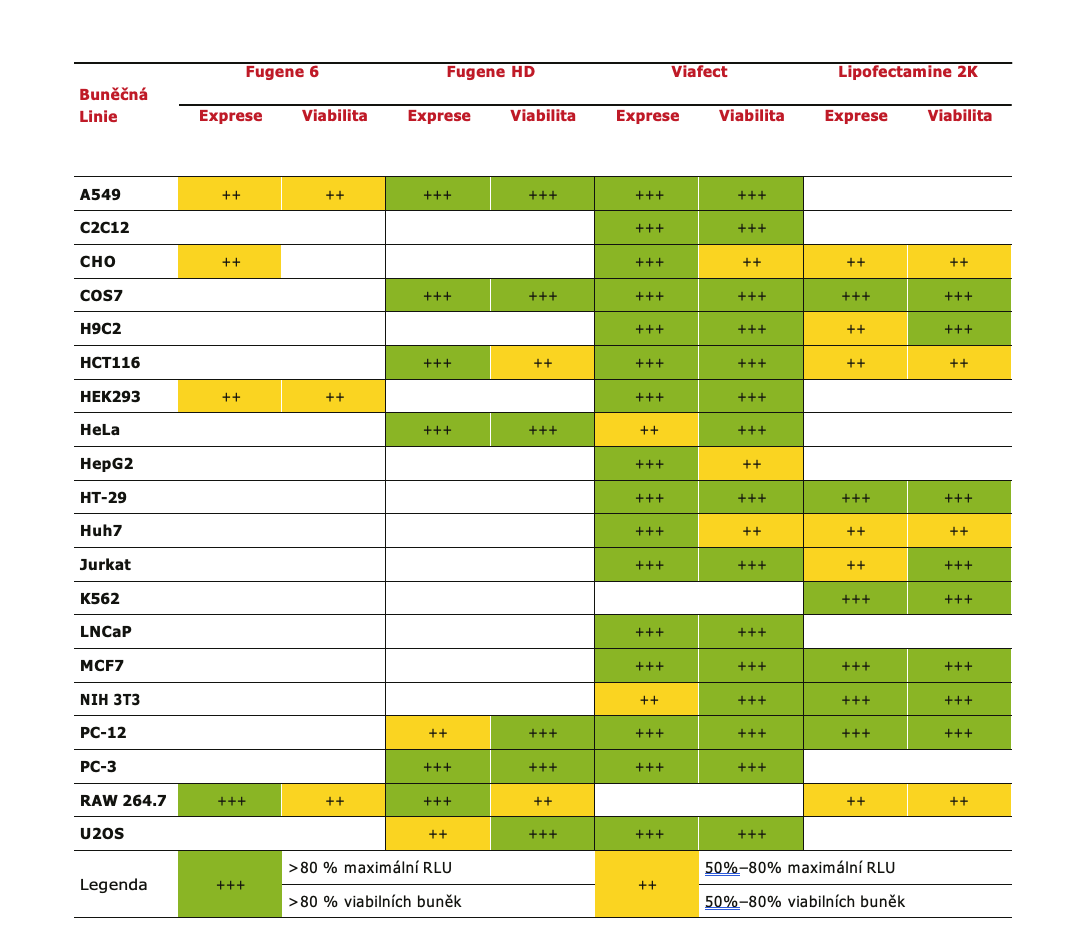
Tabulka 1 Srovnání transfekčních činidel firmy Promega a konkurence. Účinnost transfekce byla posuzována pomocí
exprese transfekovaného firefly luciferázového reportéru. Nejlepší podmínky transfekce (nejvyšší RLU) bylo vybráno pro
každé činidlo. Pro každou buněčnou linii byl výsledek s nejvyšším RLU počítán jako 100% a výsledky ostatních činidel
byly vztaženy k této hodnotě. Transfekce s účinností menší než 50 % nejsou v tabulce uvedeny.
Fyzikální metody
Fyzikální metody vytváří dočasné póry v buněčné, případně i jaderné membráně, za pomocí mechanického namáhání nebo elektrického proudu. Skrz tyto póry pak transfekovaná DNA proniká do buněk. Mezi fyzikální metody řadíme mikroinjekci, elektroporaci a nukleofekci.
Mikroinjekce je speciální metodou, při které se pod mikroskopem vstříkne velmi tenkou kapilárou genetický materiál do cytoplazmy nebo jádra buněk. Využívá se zejména pro tvorbu transgenních organismů, kdy se genetický materiál vstříkne přímo do jádra oplozených oocytů. Takto lze vypěstovat různě geneticky modifikovaná zvířata. Častěji používanou metodou je elektroporace, při které se buňky suspendují ve vodivém pufru a vložením krátkých, vysokonapěťových pulzů dojde k tvorbě pórů v cytoplazmatické membráně. Elektrický potenciál na membráně pak způsobuje, že nabité molekuly (nukleové kyseliny) přechází skrz póry do cytoplazmy. Elektroporace je metoda rychlá a jednoduchá s poměrně vysokou účinností. Vyžaduje ale speciální zařízení (elektroporátor) a optimalizaci pulzů pro každou buněčnou linii. Vzhledem k tomu, že dochází k porušení cytoplazmatické membrány, mohou mít transfekované buňky kvůli nedokonalé opravě membrány výrazně nižší viabilitu ve srovnání s chemickými a virálními metodami. Zvláštním typem elektroporace je nukleofekce firmy Lonza. Ta probíhá ve speciálním přístroji Nucleofector a využívá také elektrických pulzů. Díky jejich optimalizaci a optimalizovanému složení pufru pro každý typ buněk ale vstupuje transfekovaná DNA přímo do jádra buněk. Díky tomu není tento typ transfekce závislý na mitóze, je vhodný i pro nedělící se buňky a při použití konvenční 24-jamkové kultivační desky s ponornými elektrodami lze transfekovat i adherentní buňky, jako jsou např. neurony. Optimalizované podmínky mají za výsledek také to, že je nukleofekce šetrnější a buňky vykazují po transfekci vyšší viabilitu než po klasické elektroporaci. V závislosti na počtu a objemu vzorků lze transfekce škálovat pro větší počty i objemy vzorků. Detailnější informací o přístroji 4D Nucleofector se dozvíte v našem článku zde.

Obr. 3 Přístroj Nucleofector 4D
Poslední fyzikální metodou je tzv. biolistická transfekce, která byla původně vyvinuta pro transfekci rostlinných buněk, jelikož proniká přes buněčnou stěnu. Při biolistické transfekci je nukleová kyselina imobilizována na povrchu mikro nebo nanočástic, které jsou následně urychleny na vysokou rychlost pomocí tzv. genového děla (gene gun) a doslova nastřeleny do buněk. Účinnost transfekce tudíž nezávisí na biochemických vlastnostech nebo rychlosti růstu. Biolistickou metodu lze použít pro in vivo i in vitro transfekci a díky možnosti částic pronikat velmi hluboko lze transfekovat buňky uvnitř tkání a využít ji např. pro genovou terapii. Hlavní nevýhodou je zatím velmi vysoká pořizovací cena přístroje (gene gun), ačkoliv samotný jeho provoz je relativně levný.
Kterou transfekční metodu tedy zvolit?
Z textu výše je celkem patrné, že neexistuje univerzální metoda, která by byla použitelná pro všechny aplikace. Všechny metody mají svá pro a proti a vždy je potřeba zvážit, s jakým typem buněk pracujete, jak velkou nukleovou kyselinu potřebujete do buněk dostat a v neposlední řadě také jaké máte finanční možnosti. Pokud pracujete s běžně používanými buněčnými liniemi, je obvykle ideální začít s lipofekcí. Jedná se o jednoduchou metodu, která vyžaduje jen jednoduchou optimalizaci a je vhodná i pro high-throughput screening. Pokud pracujete s primárními nebo kmenovými buňkami, je vhodnější sáhnout po nukleofekci, která zajišťuje vyšší účinnost a při použití doporučených protokolů i úspěšnost hned při prvních experimentech.
Potřebuje poradit? Kontaktujte nás!
Aplikační a obchodní podpora Promega transfekční činidla – Ing. Vojtěch Ledvina, Ph.D., vojtech.ledvina@eastport.cz, 725 320 796
Obchodní podpora Lonza Nucleofector – Mgr. Patrícia Holubová, patricia.holubova@eastport.cz, 721 867 038
Aplikační podpora Lonza přístrojová technika – Ing. Vojtěch Andrle, vojtech.andrle@eastport.cz, 724 241 350