Nukleofekce: Vstup do světa efektivní transfekce
Schopnost transfekce DNA a RNA je v přírodních vědách klíčová. Metoda elektroporace umožňuje účinnou transfekci, ale její vysoká toxicita omezuje její použití. Technologie Nucleofector® od společnosti Lonza nabízí vylepšenou elektroporaci pro účinnou transfekci primárních buněk, kmenových buněk a neuronů, otevírající nové možnosti pro výzkum nemocí a vývoj terapií, včetně rozvoje genových terapií, imunoterapií a tvorby kmenových buněk.
Obsah
- Úvod do nukleofekce
- Co je Nucleofector® technologie (nukleofekce)
- Jaké hlavní výhody nabízí Nucleofector® technologie
- Flexibilní škálování a adherentní elektroporace pomocí nukleofekce
- Často kladené otázky k nukleofekci
- Kde se technologie Nucleofector® úspěšně používá
Úvod do nukleofekce
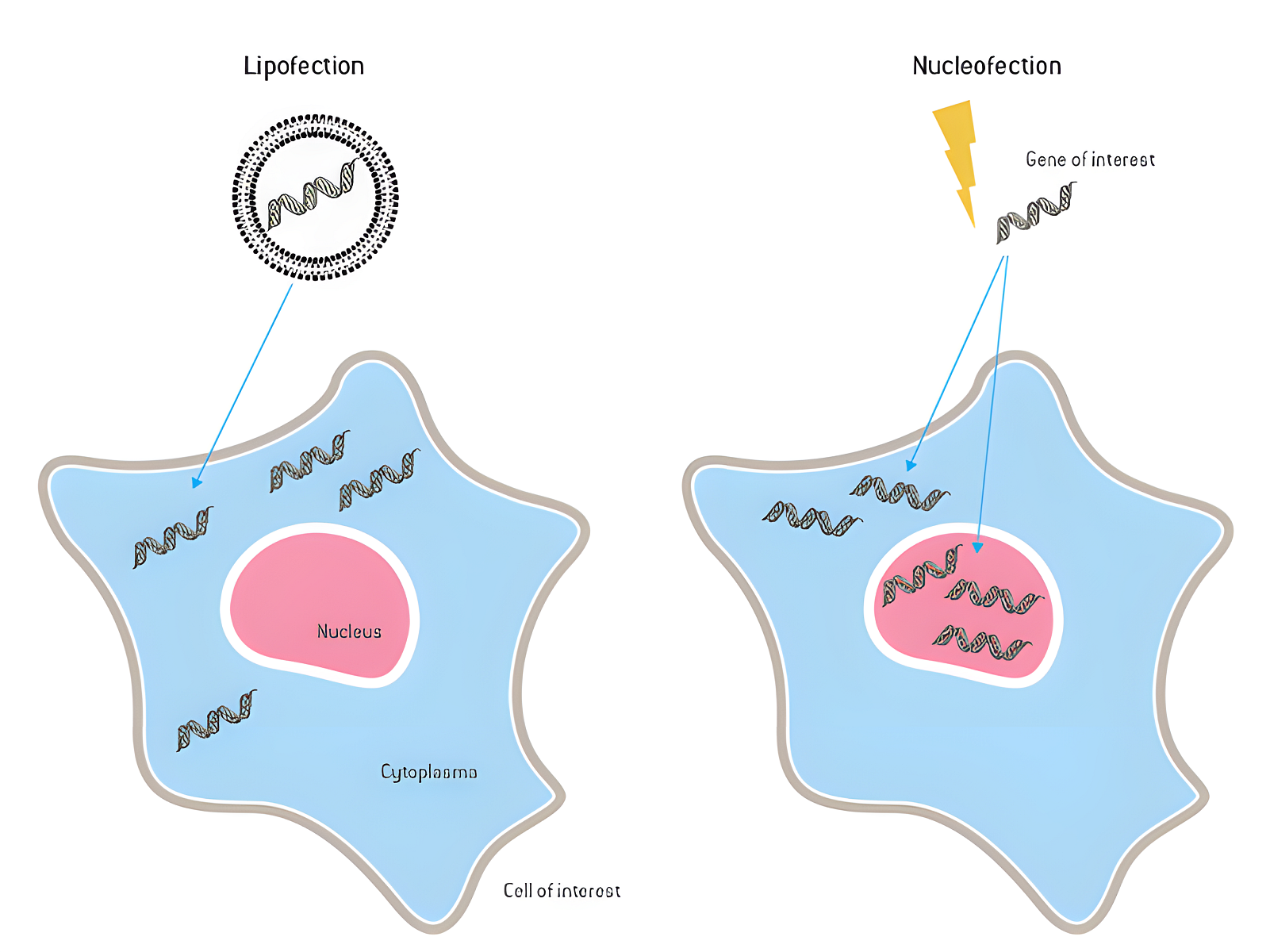
Schopnost vkládat DNA, RNA nebo proteiny do buněk, a měnit tak jejich genotyp nebo fenotyp (proces zvaný transfekce), je klíčová pro celou řadu aplikací v přírodních vědách. Existují různé typy transfekčních metod a výběr vhodného postupu často závisí na jeho vhodnosti pro danou aplikaci. Elektroporace je fyzikální transfekční metoda, která permeabilizuje buněčnou membránu použitím elektrického impulzu a přesouvá molekuly prostřednictvím elektrického pole do buňky. Je to výkonný nástroj pro transfekci velkých fragmentů DNA a dosažení dobré účinnosti transfekce v buněčných liniích. Vzhledem k vysoké toxicitě je však tradiční elektroporace méně úspěšná pro účinnou transfekci biologicky relevantnějších primárních buněk a kmenových buněk, což omezuje její použití.
Lonza řešením je vylepšená elektroporační technologie, takzvaná Nucleofector® Technology, kterou původně uvedla na trh starší společnost Amaxa v roce 2001. Umožňuje vysoce účinnou transfekci primárních buněk, kmenových buněk, neuronů a buněčných linií, které bylo tradičně obtížné transfekovat pomocí elektroporace a jiných nevirových transfekčních metod. V posledních letech se tak otevřely nové možnosti pro výzkum nemocí a vývoj terapií, včetně rozvoje genových terapií, imunoterapií a tvorby kmenových buněk.
V následujících řádcích najdete přehled technologie Nucleofector® a jaké výhody může přinést vašemu výzkumu oproti tradičním elektroporačním metodám.
Objevíte také transfekční schopnosti a flexibilní škálování, které nabízejí různé platformy Nucleofector®, a pak si můžete vybrat, která z nich je nejvhodnější pro vaši konkrétní aplikaci a pro svůj výzkum získáte tu nejvyšší úroveň účinnosti a kvality transfekce.
Co je Nucleofector® technologie (nukleofekce)
Technologie Nucleofector® využívá specifickou kombinaci optimalizovaných elektrických parametrů a roztoků specifických pro daný typ buněk, která umožňuje přenos molekuly přímo do buněčného jádra. Díky této nezávislosti na buněčné proliferaci umožňuje účinnou transfekci i nedělících se primárních buněk (jako jsou klidové T buňky nebo neurony) a také urychluje expresi.
Pro úspěšnou a účinnou transfekci primárních buněk nebo buněčných linií pomocí různých substrátů jsou klíčové tři specializované komponenty:
1. Zařízení Nucleofector®, které obsahuje jedinečné elektrické parametry naprogramované pro každý
optimalizovaný typ buněk, aby se substrát dostal přímo do buněčného jádra a cytoplazmy. Různé platformy,
které Lonza nabízí, poskytují různé specifikace pro různé aplikace.
2. Kity Nucleofector® obsahující speciální roztoky a kyvety, či stripy Nucleofector®. Ty fungují jako ochranné
prostředí pro vysokou účinnost transfekce a životaschopnost buněk při zachování fyziologicky relevantních
buněčných podmínek. Součastí je i fluorescenčně značený kontrolní vektor (pmaxGFPTM Control Vector).
3. Optimalizované protokoly nabízející komplexní návod pro optimální podmínky nukleofekce spolu s tipy pro
získávání buněk, pasážování, růstové podmínky a média pro kultivaci po transfekci. Více informací o optimalizaci
podmínek Nucleofection® se dozvíte také zde.
Od uvedení technologie Nucleofector® Legacy Amaxa na trh, společnost Lonza kolem těchto tří komponent zavedla několik inovací, aby se rozšířilo její použití pro další typy buněk, nižší a vyšší počty buněk nebo různé počty vzorků.
Jaké hlavní výhody nabízí Nucleofector® technologie
Nucleofector® Technologie nabízí vyšší účinnost transfekce než jiné nevirové transfekční metody (včetně tradiční elektroporace1) a další významné výhody uvedené níže.
Díky své vynikající transfekční účinnosti nabízí Nukleofekce oproti tradičním elektroporačním metodám různé výhody:
- Vysoká účinnost transfekce až 90 % pro plazmidovou DNA a 99 % pro oligonukleotidy, jako je siRNA.
- Vynikající zachování fyziologického stavu a životaschopnosti transfekovaných buněk.
- Možnost analýzy výsledků transfekce již krátce po transfekci.
- Snadno použitelná technologie s více než 650 protokoly specifickými pro jednotlivé typy buněk,
které vedly k přímému úspěchu transfekce.
- Transfekce široké škály substrátů, včetně DNA, mRNA, miRNA, siRNA, peptidů nebo proteinů.
- Transfekce obtížně transfekovatelných buněk, včetně primárních buněk, kmenových buněk, neuronů a
buněčných linií, a také adherentních buněk.
Kromě toho může použití technologie Nucleofector® přinést různé praktické výhody pro váš výzkum, včetně:
- Spolehnutí se na osvědčenou, účinnou a inovativní technologii,
která se objevila ve více než 8000 recenzovaných publikacích po celém světě.
- Snížení rizika kontaminace díky jednorázovým sterilním kyvetám a stripům Nucleocuvette®.
- Vynikající technickou a aplikační podporu od vysoce kvalifikovaného týmu vědců.
- Snadné rozšíření vašeho výzkumu díky flexibilním možnostem škálování různých platforem Nucleofector®,
včetně transfekce s nízkou, střední a vysokou výkonností a snadného přenosu podmínek mezi různými
platformami zařízení.
Tyto výhody mohou usnadnit řadu aplikací, jako je například terapeutický knock – down genů pomocí RNAi nebo CRISPR a generování indukovaných pluripotentních kmenových buněk nebo CAR-T terapie a mnoho dalších. Není proto divu, že se technologie Nucleofector® nyní používá v mnoha různých oblastech výzkumu, včetně funkční a strukturní genomiky, objevování léčiv a u genové a buněčné terapie.
Maasho et al 2004 Journal of Immunological Methods
Marques and Williams, 2005 Nature Biotechnology
Seki A, Rutz S, 2018 J Exp Med
Kaji et al. 2009 Nature
Monjezi et al 2017
Flexibilní škálování a adherentní elektroporace pomocí nukleofekce
Lonza vyvinula různé platformy Nucleofector®, které nabízejí řadu různých specifikací a jednotek umožňujících flexibilní škálování (tj. nukleofekci různého počtu a objemu buněk v závislosti na aplikaci) i transfekci adherentních buněk.
Systém 4D-Nucleofector®
Tento pokročilý, flexibilní a pohodlný systém 4D-Nucleofector® zahrnuje základní jednotku 4D-Nucleofector® Core Unit, která je řídící jednotkou a udává sílu a frekvenci s jakou je aplikován elektrický proud pro dosažení účinné transfekce. Obsahuje dotykovou obrazovku a ovládací intuitivní software.
Součástí 4D-Nucleofector® systému jsou také následující funkční jednotky a přídavná zařízení s různými transfekčními schopnostmi, které vyhovují různým aplikacím:
4D-Nucleofector® X Unit : Transfekce různých počtů buněk v různých formátech
Jednotka 4D-Nucleofector® X umožňuje použití 20 µl Nucleocuvette® stripů a 100 µl jednotlivých Nucleocuvette® kyvet. Podmínky lze plynule přenášet mezi těmito dvěma typy nádob. Kromě toho lze buňky, které byly transfekovány pomocí jednotky X, přenést na jiné platformy Nucleofector® (96-jamkové zařízení Shuttle®, systém HT Nucleofector® a jednotka 4D-Nucleofector® LV) bez nutnosti opětovné optimalizace. Více informací získáte shlédnutím videa.
4D-Nucleofector® Y Unit: Adherentní elektroporace
Elektroporace obvykle vyžaduje, aby byly buňky pro transfekci v suspenzi. Jednotka 4D-Nucleofector® Y Unit však nabízí možnost udržovat buňky během elektroporace v adherenci.
4D-Nucleofector® 96-well Unit: Přídavné zařízení pro 96-jamkovou transfekci
Jednotka 4D-Nucleofector® 96-well Unit nabízí přídavné zařízení pro systém 4D-Nucleofector® se střední kapacitou. Je vhodná pro pohodlnou optimalizaci podmínek Nucleofection® nebo jako nástroj pro screeningové testy. Pro škálovatelnou výkonnost lze každou jamku destičky nastavit a transfekovat samostatně. To je užitečné pro optimalizaci obtížně transfekovatelných buněčných linií na jedné destičce a také pro transfekci variabilního počtu buněk od 104 do 106 buněk na reakci.
Adherentní primární buňky, zejména neurony, v definovaných vývojových stádiích lze transfekovat pomocí jednotky Y bez ovlivnění jejich funkčnosti a s účinností až 70 %.
4D-Nucleofector® LV Unit: Transfekce ve velkém měřítku
Jednotka 4D-Nucleofector® LV Unit umožňuje uzavřenou, škálovatelnou a sterilní transfekci většího počtu buněk v rozsahu 1x107 až 1x109 buněk. Nabízí dva formáty pro transfekci ve velkém měřítku, 1 ml Nucleocuvette® Cartridges nebo LV Nucleocuvette® Cartridges pro objem až 20 ml, v závislosti na aplikaci a na tom, kolik buněk je třeba transfekovat. Díky možnostem transfekce ve velkém měřítku je jednotka LV vhodná pro širokou škálu aplikací. Spotřební materiál TheraPEAK® třídy GMP a software vyhovující 21CFR část 11 a služby IQOQ umožňují rychle převést výsledky výzkumu do výrobního procesu buněčné terapie vyhovujícího GMP podmínkám. Lepší představu o transfekci pomocí LV Unit najdete ve videu.
Systém HT Nucleofector®: Vysoce výkonná transfekce
Systém HT Nucleofector® je nezávislá platforma nabízející vysoce výkonnou transfekci ve formátu 384 jamek. Díky extrémně rychlému zpracování destiček do jedné minuty a vysoké reprodukovatelnosti je ideálním nástrojem pro screeningové aplikace.
Často kladené otázky
Je váš kontrolní vektor pmaxGFP dodávaný s kity Nucleofector® vhodný pro stabilní expresi?
Tento vektor je dodáván v našich kitech Nucleofector® pouze jako pozitivní kontrola a nelze jej použít k selekci, protože neobsahuje selekční marker savců. Jediný gen rezistence exprimovaný tímto vektorem je kanamycin, který je vhodný pouze pro bakteriální selekci.
Záleží na tom, zda PBS použitý pro obohacení monocytů obsahuje vápník a hořčík, pokud mají být buňky později použity v Nucleofection®?
PBS by měl být bez vápníku a hořčíku, aby se zabránilo shlukování buněk.
Mohou problémy s přílivem vápníku ovlivnit životaschopnost nebo diferenciaci kmenových buněk po nukleofekci®?
Při transfekci buněk pomocí Nucleofection® vznikají v buněčné membráně přechodné póry. Obecně tyto póry zmizí do 15 minut po transfekci, ale pokud jsou buňky ihned po Nucleofection® vloženy do média, které obsahuje vysoké množství vápenatých iontů (např. DMEM), mohou vápenaté ionty proniknout do buňky a aktivovat dráhy citlivé na vápník.
U kmenových buněk je jistě možné, že příliv vápenatých iontů do těchto buněk je může nepříznivě ovlivnit. Existuje mnoho signálních transdukčních drah, které jsou aktivovány přítokem vápníku, a u některých typů kmenových buněk část různých diferenciačních signálů zahrnuje přítok vápníku. U jiných typů buněk jsme také pozorovali, že aktivace signálních transdukčních drah bezprostředně po Nucleofection® může způsobit zvýšenou buněčnou smrt, a to by se pravděpodobně mohlo stát i u kmenových buněk.
Tento potenciální problém lze eliminovat použitím média bez vápníku. Po nukleofekci přidejte do kyvety obsahující nukleofekované buňky 500 µl bezvápenaté verze vašeho růstového média (se sérem nebo bez něj), opatrně odeberte buněčnou suspenzi, umístěte ji do mikrocentrifugační zkumavky a poté zkumavku umístěte při 37 °C (buď do inkubátoru, nebo do tepelného bloku). Po 10-15 minutách se póry vzniklé během Nucleofection® uzavřou nebo se již uzavřely a buňky lze bezpečně přesunout do běžného růstového média jako obvykle. Protože jsou póry v této době již většinou uzavřeny, přítomnost vápenatých iontů v médiu buňky neovlivní. Ačkoli doporučujeme použití verze vašeho běžného růstového média bez obsahu vápníku, mnoho lidí místo toho úspěšně používá médium s nízkým obsahem vápníku, jako je RPMI, a to zůstává pro tento účel snadno dostupnou alternativou "obnovovacího média".
Jaké jsou požadavky na přímou nukleofekci® mRNA pro expresi proteinu?
mRNA by měla být uzavřená a polyadenylovaná. Podmínky Nucleofection® budou stejné jako pro DNA s daným typem buněk, tj. bude třeba postupovat podle stejného protokolu a použít stejný program, jen bude pravděpodobně třeba přidat mnohem větší množství nukleové kyseliny, 10-20 ug. To musí být provedeno v objemu menším nebo rovném 1/10 velikosti vzorku (tedy méně než 10 µl pro 100 µl reakce), takže může být nutné mRNA zkoncentrovat. Zde je odkaz, který může být také užitečný: Nucleofection® of mRNA (Miyahara et al., Clin Cancer Res (2005) 11(15): 5581-5589; Van De Parre et al., Biochem Biophys Res Commun (2005) 327(1): 356-360; Coughlin et al.; Blood (2004) 103: 2046).
Další otázky a odpovědi najdete na stránce Lonza knowledge centra.
Kde se technologie Nucleofector® úspěšně používá?
S technologií Nucleofector® mají bohaté zkušenosti na Klinice dětské hematologie a onkologie 2. lékařské fakulty, Univerzity Karlovy:
"Nucleofector 4D (Lonza) je klíčovým přístrojem pro naše experimenty využívající genovou editaci, díky kterému můžeme efektivně pracovat se širokou škálou buněčných typů a editačních reagencií. Nukleofekci, která je velmi účinným podtypem elektroporace, využíváme pro transfekci především lidských a myších buněčných linií i primárních buněk jak plazmidovou DNA, tak RNA reagenciemi nebo ribonukleotidovými partikulemi. Při práci oceňujeme podjednotku X využívající 16-jamkové stripy, které nám umožňují testovat více experimentálních podmínek najednou na menších množstvích buněk oproti standardní kyvetě. V rámci zavádění technologie jsme ocenili také podporu jak firmy Eastport, tak i výrobce, a od té doby - již více než 4 roky - vše funguje bez problémů."
Autorka článku
|
|
Mgr. Patrícia Holubová aplikační a produktový specialista buněčná biologie, detekce endotoxinů, biotechnologie |
email: patricia.holubova@eastport.cz tel.: 721 867 038

