Luciferázové reportéry a jejich využití
Reportérové eseje jsou jednou z účinných metod pro měření biologické odpovědi organismů. Připojením reportérové sekvence ke sledovanému genu lze snadno měřit míru exprese daného genu, případně kvantifikovat a sledovat interakce proteinu kódovaného daným genem. Reportérových genů je celá řada, ale v současnosti nejpoužívanějšími jsou jednoznačně fluorescenční proteiny, jako je GFP, YFP nebo mCherry a luciferázové enzymy. Luciferázové reportéry mají oproti fluorescenčním několik zásadních výhod. Jsou citlivější, kvantitativní v širokém rozsahu koncentrací a díky absenci potřeby excitačního světla mají jen minimální pozadí. Nejčastěji používanými luciferázami jsou Renilla luciferáza (Rluc), tzv. Firefly luciferáza izolovaná ze světlušek druhu Photinus pyralis (Fluc) a Nano luciferáza (Nluc), což je modifikovaná luciferáza z mořské krevety Oplophorus gracilirostris.
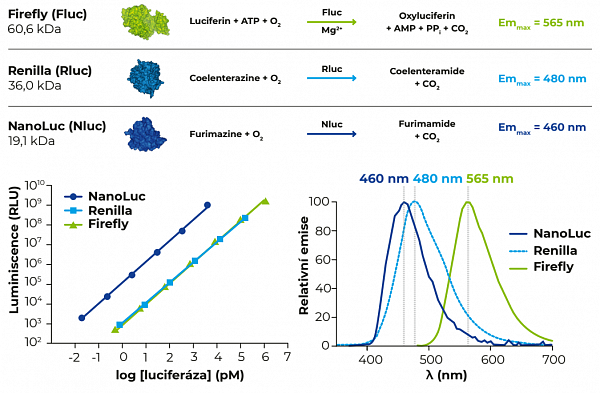
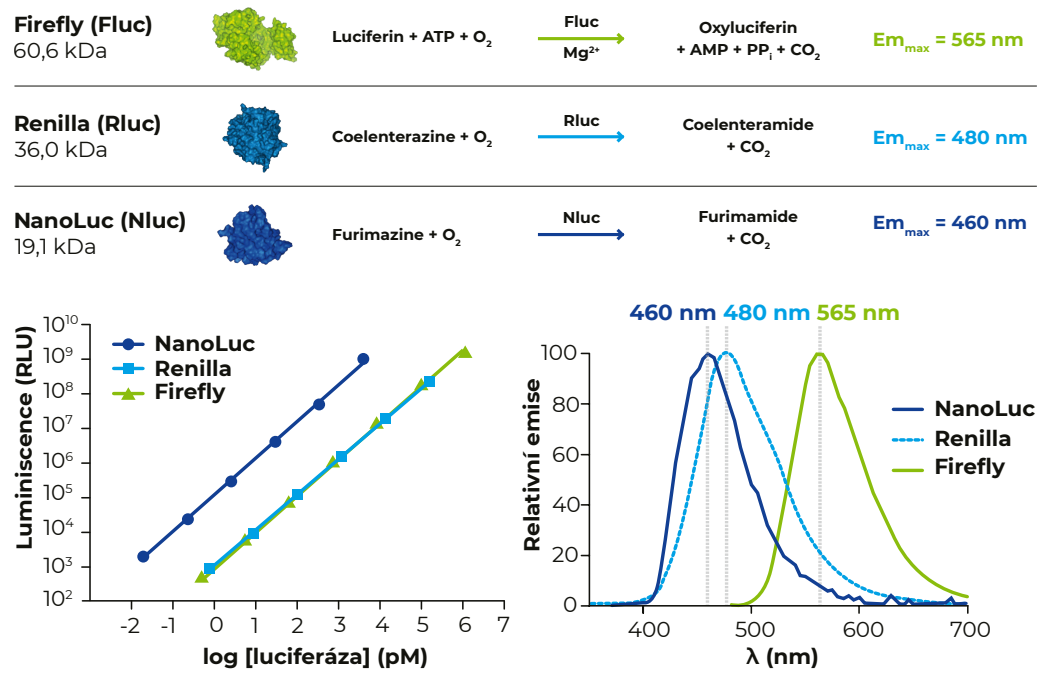
Jednotlivé luciferázy se liší zejména svojí velikostí, stabilitou, spektrem emitovaných vlnových délek, jasem a typem zpracovávaného substrátu (viz Obr. 1). Nluc má kromě nejmenší velikosti výhodu i v tom, že poskytuje asi 100× intenzivnější signál než zbylé dvě luciferázy a je tedy vhodná i pro sledování genů s nízkou hladinou exprese. Vysoký jas navíc umožňuje její snadné použití jako donoru v NanoBRET esejích v kombinaci s fluorescenčními značkami.
Obr. 1 Srovnání vlastností jednotlivých luciferáz. NanoLuc luciferáza je nejmenší luciferáza s nejintenzivnější luminiscencí a nejkratší emitovanou vlnovou délkou.
Možnosti kvantifikace reportérových genů
Při klasických experimentech s využitím overexprese se prvně vytvoří reportérový vektor, který je poté vpraven do buněk pomocí stabilní nebo přechodné transfekce a sleduje se odezva buněk po specifickém treatmentu. Díky vysoké citlivosti luminiscenčního stanovení lze detekovat už asi 10-20 mol luciferázy a stanovení má široký lineární rozsah. Kvantifikaci lze provést více způsoby. Prvním nejběžnějším přístupem je přídavek lyzačního pufru s obsahem detergentu a luminiscenčního substrátu. Při použití luciferázového reportéru s IL-6 sekrečním signálem je luciferáza uvolňována z buněk a stanovení lze provést po odběru vzorku média v separátní mikrotitrační destičce. Rluc a Nluc luciferázy lze navíc použít i pro kinetické měření v živých buňkách, protože jejich substráty jsou schopny pronikat přes membránu buněk.
Obecně se při kvantifikaci luciferázových reportérů používají dva základní typy esejí. Tzv. "flash" a "glow" eseje. "Flash" eseje nebo také zábleskové eseje generují rychlý velmi intenzivní záblesk bioluminiscenčního záření, který ale rychle vyhasíná, a vyžadují použití readeru s injektory pro dávkování detekčního činidla. Tzv. "glow" eseje pak generují méně intenzivní, ale stabilnější signál s delší dobou dosvitu. Glow eseje nevyžadují použití readeru s injektory a jsou vhodné i pro „high-throughput“ experimenty, jelikož nedochází ke zkreslení výsledků vlivem pomalého pipetování. Systémů kompatibilních s klasickou „světluškovou“ firefly luciferázou je hned několik a liší se intenzitou a stabilitou signálu. Nejstarší a nejcitlivější firefly esejí je Luciferase Assay System. Jedná se o „flash“ esej s intenzivním signálem, ale velmi krátkým poločasem poklesu signálu (10–15 min.), která je určená pro měření v luminometrech s injektory. Druhou nejcitlivější esejí je Bright-Glo™ Luciferase Assay System, která má oproti ostatním firefly lucife‐ rázovým „glow“ esejím nejvyšší citlivost a zároveň kratší dobu dosvitu, kdy signál klesne na polovinu asi po 30 minutách. Hojně využívanou zlatou střední cestou je ONE-Glo™ Luciferase Assay System, který je o něco méně citlivější než Bright-Glo, ale poločas poklesu signálu je vyšší – více než 45 minut. Tento systém je založen na modifikovaném substrátu, díky němuž vykazuje vyšší odolnost vůči složkám kultivačního media a je tak stabilnější. Lze jej proto dlouhodobě uchovávat i při 4 °C, díky čemuž je snadno adaptovatelný i pro high-throughput aplikace. Nejstabilnějším systémem je pak Steady-Glo™ Luciferase Assay System. Pokles signálu na polovinu je v tomto případě patrný až po 5 hodinách. Steady-Glo tedy poskytuje reprodukovatelné výsledky po dobu několika hodin výměnou za slabší signál.
| Název produktu | Kód zboží | |
| E1483 |  |
|
| E2610 |  |
|
| E6110 |  |
|
| E2510 |  |
Kompletní nabídka luciferázových esejí v e-shopu
Pro stanovení NanoLuc luciferázy lze použít jedinou eseje, a to Nano-Glo® Luciferase Assay System. Jedná se o nejcitlivější esej, která je asi 100× citlivější než Renilla a firefly eseje a má široký dynamický rozsah, ve kterém je signál lineární přes cca 6 řádů. Zároveň je vysoce stabilní a generuje signál s dlouhým poločasem poklesu signálu asi 120 minut. Substrátem je v tomto případě furimazin. Ten je schopen pronikat přes membránu buněk a je tedy možné provádět i kinetická stanovení s živými buňkami pomocí Nano-Glo® Live Cell Assay System.
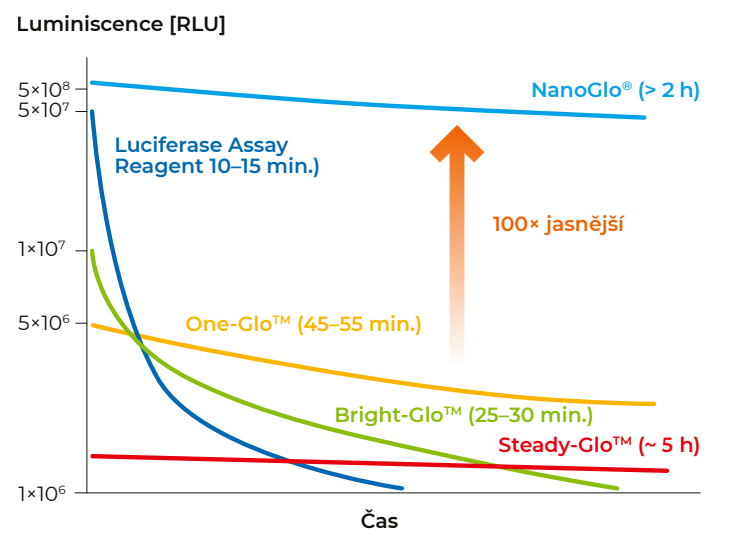
Obr. 2 Srovnání intenzity a stability signálu jednotlivých luciferázových esejí od firmy Promega
Duální reportérové eseje
Většina reportérových esejí využívá jeden nebo dva reportérové geny. Při použití dvou reportérů je spolu s experimentálním vektorem kotransfekován i kontrolní vektor. Ten je většinou řízen konstitutivním promotorem, je kontinuálně exprimován a slouží k normalizaci signálu na počet buněk nebo na procento účinnosti transfekce. Další možností použití dvou reportérů je pro eliminaci falešně pozitivních výsledků při testování látek na buňkách. Některé látky totiž mohou přímo interagovat s luciferázami a stabilizovat je. Použitím koincidenčních reportérových vektorů, které kódují dvě odlišné luciferázy – Fluc a Nluc, lze snadno posoudit, jestli testovaná látka opravdu indikuje expresi sledovaného genu nebo pouze stabilizuje některou z luciferáz. Pokud po treatmentu detekujeme nárůst signálu obou luciferáz, jedná se o pozitivní výsledek. Pokud narůstá signál jen jedné z luciferáz, jedná se o stabilizaci luciferázy danou látkou (viz Obr. 2). Poslední možností využití dvou reportérů je sledování dvou různých odpovědí buněk v jednom vzorku. Při použití dvou reportérů je samozřejmě nutné použít rozdílné reportérové geny, aby bylo možné stanovit zvlášť aktivity obou reportérů. Nejčastějšími kombinacemi experimentální-kontrolní reportér jsou Fluc-Rluc nebo Nluc-Fluc.
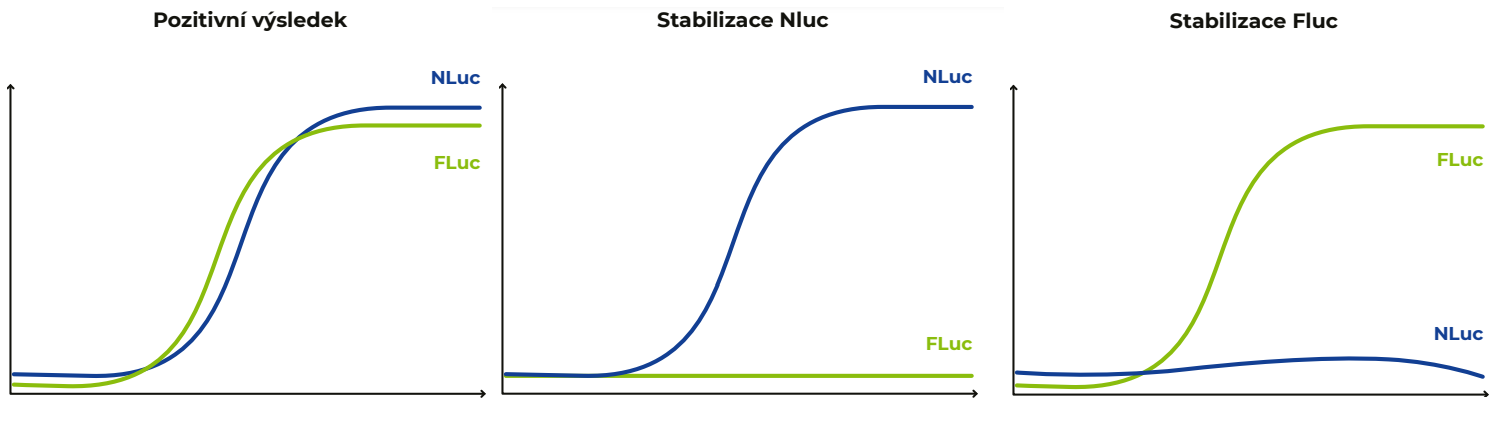 Obr. 3 Schématické zobrazení aktivity Nluc a Fluc luciferáz po treatmentu třemi domnělými aktivátory. Nárůst aktivity obou luciferáz indikuje skutečný aktivační účinek dané látky. Pokud se nárůst signálu obou luciferáz neshoduje a dochází k aktivaci pouze jedné z nich, jedná se o nespecifický účinek.
Obr. 3 Schématické zobrazení aktivity Nluc a Fluc luciferáz po treatmentu třemi domnělými aktivátory. Nárůst aktivity obou luciferáz indikuje skutečný aktivační účinek dané látky. Pokud se nárůst signálu obou luciferáz neshoduje a dochází k aktivaci pouze jedné z nich, jedná se o nespecifický účinek.
I pro měřeních duálních reportérových esejí, nabízí společnost Promega několik možností. Během stanovení dvou luciferáz v jednom vzorku se ke vzorku přidá vždy nejprve činidlo pro stanovení prvního reportéru a změří se hodnota signálu. V druhém kroku se pak přidá druhé činidlo, které zastaví první reportér a zároveň obsahuje pufr a substrát pro druhou luciferázu. V případě současného použití Fluc a Rluc je možnost detekce pomocí „flash“ nebo „glow“ eseje. „Flash“ esej Dual-Luciferase Reporter Assay System má intenzivní signál ale velmi krátkou dobu dosvitu a vyžaduje reader vybavený injektory. „Glow“ esej Dual-Glo Luciferase Assay System má pak o trochu slabší signál, ale mnohem delší dobu dosvitu a je tak vhodná pro měření více vzorků i na readerech bez injektorů. V případě kombinace Nluc-Fluc je dostupná jen „glow“ esej Nano-Glo Dual Luciferase Reporter Assay System, která je díky vysokému jasu Nluc velmi citlivá a zároveň pohodlná na provedení (pouze dva pipetovací kroky).
Kromě detekčních kitů nabízí společnost Promega i široký výběr hotových vektorů se všemi zmíněnými luciferázami, přičemž jsou dostupné kombinace různých forem enzymů (sekretovaná, destabilizovaná, stabilní), promotorů, markerů pro selekci pomocí antibiotik a (ne)přítomnosti mnohočetného klonovacího místa. Nejaktuálnější nabídka vektorů je vždy dostupná na webu Promegy.
pGL4 firefly luciferázové reportérové vektory
|
Vektor |
Reportérový gen |
Mnohočetné klonovací |
Sekvence pro degradaci proteinu |
Genový promotor |
Selekční marker |
|
pGL4.10 |
luc2 |
Ano |
Ne |
Ne |
Ne |
|
pGL4.11 |
luc2P |
Ano |
hPEST |
Ne |
Ne |
|
pGL4.12 |
luc2CP |
Ano |
CL1-hPEST |
Ne |
Ne |
|
pGL4.13 |
luc2 |
Ne |
Ne |
SV40 |
Ne |
|
pGL4.14 |
luc2 |
Ano |
Ne |
Ne |
Hygro |
|
pGL4.15 |
luc2P |
Ano |
hPEST |
Ne |
Hygro |
|
pGL4.16 |
luc2CP |
Ano |
CL1-hPEST |
Ne |
Hygro |
|
pGL4.17 |
luc2 |
Ano |
Ne |
Ne |
Neo |
|
pGL4.18 |
luc2P |
Ano |
hPEST |
Ne |
Neo |
|
pGL4.19 |
luc2CP |
Ano |
CL1-hPEST |
Ne |
Neo |
|
pGL4.20 |
luc2 |
Ano |
Ne |
Ne |
Puro |
|
pGL4.21 |
luc2P |
Ano |
hPEST |
Ne |
Puro |
|
pGL4.22 |
luc2CP |
Ano |
CL1-hPEST |
Ne |
Puro |
|
pGL4.23 |
luc2 |
Ano |
Ne |
minP |
Ne |
|
pGL4.24 |
luc2P |
Ano |
hPEST |
minP |
Ne |
|
pGL4.25 |
luc2CP |
Ano |
CL1-hPEST |
minP |
Ne |
|
pGL4.26 |
luc2 |
Ano |
Ne |
minP |
Hygro |
|
pGL4.27 |
luc2P |
Ano |
hPEST |
minP |
Hygro |
|
pGL4.28 |
luc2CP |
Ano |
CL1-hPEST |
minP |
Hygro |
|
pGL4.29 |
luc2P |
Ne |
hPEST |
minP + CRE |
Hygro |
|
pGL4.30 |
luc2P |
Ne |
hPEST |
minP + NFAT RE |
Hygro |
|
pGL4.31 |
luc2P |
Ne |
hPEST |
adenovirus major late + GAL4 UAS |
Hygro |
|
pGL4.32 |
luc2P |
Ne |
hPEST |
minP + NF-kB RE |
Hygro |
|
pGL4.33 |
luc2P |
Ne |
hPEST |
serum response element |
Hygro |
|
pGL4.34 |
luc2P |
Ne |
hPEST |
SRF RE |
Hygro |
|
pGL4.35 |
luc2P |
Ne |
hPEST |
GAL4 UAS |
Hygro |
|
pGL4.36 |
luc2P |
Ne |
hPEST |
murine mammary tumor virus long terminal repeat |
Hygro |
|
pGL4.37 |
luc2P |
Ne |
hPEST |
minP + antioxidant RE |
Hygro |
|
pGL4.38 |
luc2P |
Ne |
hPEST |
minP + p53 RE |
Hygro |
|
pGL4.39 |
luc2P |
Ne |
hPEST |
minP + ATF6 RE |
Hygro |
|
pGL4.40 |
luc2P |
Ne |
hPEST |
minP + metal RE |
Hygro |
|
pGL4.41 |
luc2P |
Ne |
hPEST |
minP + heat shock RE |
Hygro |
|
pGL4.42 |
luc2P |
Ne |
hPEST |
minP + hypoxia RE |
Hygro |
|
pGL4.43 |
luc2P |
Ne |
hPEST |
minP + xenobiotic RE |
Hygro |
|
pGL4.44 |
luc2P |
Ne |
hPEST |
minP + AP1 RE |
Hygro |
|
pGL4.45 |
luc2P |
Ne |
hPEST |
minP + interferon stimulated RE |
Hygro |
|
pGL4.47 |
luc2P |
Ne |
hPEST |
minP + Sis-inducible element RE |
Hygro |
|
pGL4.48 |
luc2P |
Ne |
hPEST |
minP + SMAD3/SMAD4 binding element RE |
Hygro |
|
pGL4.49 |
luc2P |
Ne |
hPEST |
minP + TCF-LEF RE |
Hygro |
|
pGL4.50 |
luc2 |
Ne |
Ne |
CMV |
Hygro |
|
pGL4.51 |
luc2 |
Ne |
Ne |
CMV |
Neo |
|
pGL4.52 |
luc2P |
Ne |
hPEST |
minP + STAT5 RE |
Hygro |
|
pGL4.53 |
luc2 |
Ne |
Ne |
phosphoglycerate kinase (PGK) |
Ne |
|
pGL4.54 |
luc2 |
Ne |
Ne |
thymidine kinase (TK) |
Ne |
pGL4 Renilla a pNL NanoLuc luciferázové reportérové vektory
|
Vektor |
Reportérový gen |
Mnohočetné klonovací místo |
Sekvence pro degradaci proteinu |
Genový promotor |
Selekční marker |
|
pGL4.70 |
hRluc |
Ano |
Ne |
Ne |
Ne |
|
pGL4.71 |
hRlucP |
Ano |
hPEST |
Ne |
Ne |
|
pGL4.72 |
hRlucCP |
Ano |
CL1-hPEST |
Ne |
Ne |
|
pGL4.73 |
hRluc |
Ne |
Ne |
SV40 |
Ne |
|
pGL4.74 |
hRluc |
Ne |
Ne |
HSV-TK |
Ne |
|
pGL4.75 |
hRluc |
Ne |
Ne |
CMV |
Ne |
|
pGL4.76 |
hRluc |
Ano |
Ne |
Ne |
Hygro |
|
pGL4.77 |
hRlucP |
Ano |
hPEST |
Ne |
Hygro |
|
pGL4.78 |
hRlucCP |
Ano |
Ne |
Ne |
Hygro |
|
pGL4.79 |
hRluc |
Ano |
Ne |
Ne |
Neo |
|
pGL4.80 |
hRlucP |
Ano |
hPEST |
Ne |
Neo |
|
pGL4.81 |
hRlucCP |
Ano |
CL1-hPEST |
Ne |
Neo |
|
pGL4.82 |
hRluc |
Ano |
Ne |
Ne |
Puro |
|
pGL4.83 |
hRlucP |
Ano |
hPEST |
Ne |
Puro |
|
pGL4.84 |
hRlucCP |
Ano |
CL1-hPEST |
Ne |
Puro |
|
pNL1.1[Nluc] |
Nluc |
Ano |
Ne |
Ne |
Ne |
|
pNL1.1.CMV[Nluc/ CMV] |
Nluc |
Ne |
Ne |
CMV |
Ne |
|
pNL1.2[NlucP] |
NlucP |
Ano |
hPEST |
Ne |
Ne |
|
pNL1.3[secNluc] |
secNluc |
Ano |
Ne |
Ne |
Ne |
|
pNL1.3.CMV [secNluc/CMV] |
secNluc |
Ne |
Ne |
CMV |
Ne |
|
pNL2.1[Nluc/Hygro] |
Nluc |
Ano |
Ne |
Ne |
Hygro |
|
pNL2.2[NlucP/ Hygro] |
NlucP |
Ano |
hPEST |
Ne |
Hygro |
|
pNL2.3[secNluc/ Hygro] |
secNluc |
Ano |
Ne |
Ne |
Hygro |