Vše co potřebujete vědět o extracelulárních vezikulách
Již dlouho je známo, že buňky během apoptózy uvolňují do extracelulárního prostředí vezikuly (apoptotická tělíska). Relativně nedávno ale bylo zjištěno, že i zdravé buňky uvolňují do okolí podobné vezikuly. Pro tyto váčky se používá mnoho různých názvu, např. ektozomy, mikročástice nebo vylučující se mikrovezikuly.
Jak dělíme extracelulární vezikuly?
V rámci sjednocení názvosloví se ale nyní doporučuje pro všechny druhy vylučovaných vezikul používat obecný termín extracelulární vezikuly (EV). Obecně lze EV rozdělit podle jejich buněčného původu na exozomy, mikrovezikuly a apoptotická tělíska (viz tabulka).
| Exozomy | Mikrovezikuly |
Apoptotická tělíska |
|
|
Původ |
Endocytární dráha | Plazmatická membrána | Plazmatická membrána |
|
Velikost |
40-120 nm | 50-1,000 nm | 500-2,000 nm |
|
Funkce |
Mezibuněčná komunikace | Mezibuněčná komunikace | Usnadnění fagocytózy |
| Markery | Alix, Tsg101, tetraspaniny (CD81, CD63, CD9), flotillin | Integriny, selektiny, CD40 | Annexin V, fosfatidylserin |
| Obsah | Proteiny a nukleové kyseliny (mRNA, miRNA a další nekódující RNA) | Proteiny a nukleové kyseliny (mRNA, miRNA a další nekódující RNA) | Frakce buněčného jádra, buněčné organely |
Jak vznikají exozomy a mikrovezikuly
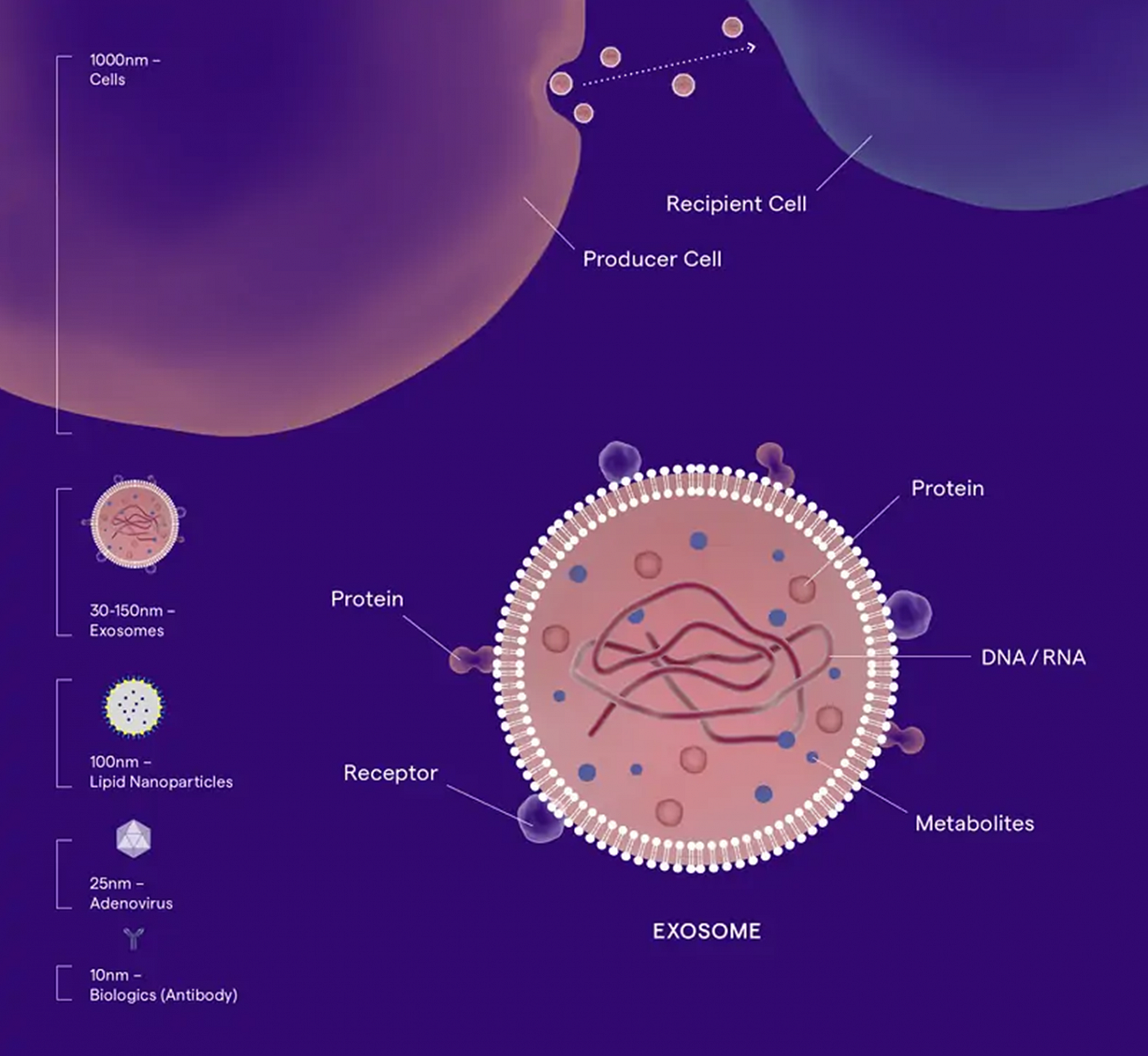
Exozomy i mikrovezikuly (MV) jsou uvolňovány zdravými buňkami, ale liší se v několika ohledech. Exozomy jsou vezikuly endocytárního původu o velikosti v řádu desítek nanometrů, které vznikají průhybem membrány multivesikulárních endozomů (MVE) směrem dovnitř, jak je znázorněno na obrázku níže. Jejich velikost je většinou 40-120 nm. Vzhledem ke svému endocytickému původu jsou exozomy běžně obohaceny o proteiny asociované s endozomy, jako jsou Rab GTPázy, SNARE, anexiny a flotillin. Některé z těchto proteinů (např. Alix a Tsg101) se běžně používají jako markery exozomů. Další hojně zastoupenou skupinou proteinů v exozomech jsou tetraspaniny (např. CD63, CD81, CD9). Jedná se o rodinu membránových proteinů, o nichž je známo, že se shlukují a tvoří mikrodomény na plazmatické membráně. Rovněž jsou považovány za jedny z markerů exozomů.
Mikrovezikuly (MV) oproti tomu vznikají na povrchu buněk a jejich velikost se může pohybovat od 50 nm až do 1 000 nm. O obsahu konkrétních proteinů v mikrovezikulech je bohužel známo méně informací. Nicméně běžnými proteinovými markery používanými k definici těchto vezikul jsou selektiny, integriny a ligand CD40. Kromě proteinů mohou EV obsahovat i nukleové kyseliny, jako je mRNA nebo miRNA. Díky svému rozmanitému obsahu představují EV velmi zajímavý potenciální zdroj pro objev nových biomarkerů onemocnění nebo látek zajišťujících mezibuněčnou komunikaci.
Funkce extracelulární vezikuly
Exozomy i MV usnadňují komunikační procesy mezi sousedícími buňkami i buňkami vzdálenými. Jejich funkce byly popsány např. při imunitní odpovědi organismu, při vývoji a degradaci nervové soustavy nebo při krevním srážení. Procesů na kterých jsou zprostředkovány EV nebo se na nich podílí, je ale samozřejmě mnohem víc a jejich počet se neustále zvyšuje.
Exozomy uvolňované imunitními buňkami mohou působit jako vezikuly prezentující antigen dalším imunitním buňkám, mohou stimulovat protinádorovou imunitní odpověď nebo naopak vyvolávat tolerogenní účinky k potlačení zánětu. Bylo také prokázáno, že nádorové buňky využívají EV k tomu, aby přispěly ke své progresi tím, že inaktivují T lymfocyty nebo NK buňky a také podporují diferenciaci regulačních T lymfocytů k potlačení imunitních reakcí.
V nervovém systému se EV podílejí na tvorbě myelinu, růstu neuritů a přežívání neuronů. Kromě toho bylo také zjištěno, že některé patogenní proteiny, jako jsou priony a β-amyloidní peptidy, využívají exozomy ke svému šíření do dalších buněk.
MV se podílejí na koagulaci a zánětu. MV pocházející z krevních destiček a monocytů jsou schopny podporovat sestavování enzymových komplexů působících na koagulační kaskádu, což vede k fúzím buněk a následné potenciální tvorbě trombů. Kromě toho mohou MV působit jako protizánětlivé i prozánětlivé faktory v závislosti na podnětu, který je generuje, a na buňce, z níž se uvolňují. V obou případech vede interakce MVs s cílovou buňkou k sekreci cytokinů, které modulují zánětlivou odpověď.
Bylo také zjištěno, že EV cirkulují v mnoha různých tělesných tekutinách včetně krve a moči. V tomto případě se pravděpodobně jedná o směs exozomů a MV. Vzhledem k podobnosti složení EV s mateřskou buňkou vzbudily cirkulující EV značný zájem jako zdroj pro objevování nových biomarkerů pro méně invazivní diagnostiku.
Přirozené funkce exozomů v těle z nich činí potenciálně silný nosič léčiv a léků
Schopnost exozomů předávat informace a stimulovat buněčnou aktivitu vedla k myšlence, že mohou sloužit i jako systém pro doručování terapeutických sloučenin zaměřených na konkrétní nemoci, zranění nebo viry. Velmi významná je hlavně jejich schopnost procházet hematoencefalickou bariérou. Exozomy lze potenciálně využít i jako vektory pro doručení proteinů nebo nukleových kyselin, které pomáhají buňkám bojovat s nemocemi, modulovat imunitní reakci a opravovat tkáně. Několik předklinických studií naznačuje silné účinky kombinace exozomů a terapeutik a objevují se první klinické údaje s povzbudivými výsledky z hlediska účinnosti i bezpečnosti. V současnosti tedy exozomy vykazují potenciál v široké škále výzkumných, diagnostických a terapeutických aplikací.
Izolace a purifikace EV
Izolace a následná analýza EV představuje několik výzev zejména kvůli jejich malé velikosti. Nejstarší a nejpoužívanější metodou izolace EV je diferenciální ultracentrifugace. Rozdíly ve vztlakové hustotě a rychlosti vznášení lze následně využít k oddělení EV na základě jejich velikosti. Od této metody se ale postupně upouští, protože při odstřeďování dochází k mechanickému namáhání a poškození vezikulů, izolace je velmi časově náročná a vyžaduje drahé a velmi rozměrné ultracentrifugy. Šetrnějším, rychlejším a uživatelsky přívětivějším postupem je izolace pomocí velikostně vylučovací chromatografie a filtrace pomocí tangenciálního proudění, které vyvíjí a vyrábí estonská společnost Hansa BioMed. Kromě izolačních nástrojů nabízí i další výrobky pro charakterizaci EV a v jejich nabídce naleznete následující:
- Standardní exozomy a mikrovezikuly
- Produkty pro izolaci a purifikaci exozomů na bázi SEC, TFF a chemické precipitacce
- Řešení pro filtraci a koncentraci EV
- Kity pro kvantifikaci a charakterizaci exozomů
- Kity pro izolaci exozomové RNA
- Kity pro izolaci EV-asociované genomové DNA
- Polyklonální a monoklonální protilátky proti běžným specifickým exozomálním markerům (CD63, CD81, ALIX)
- Servisní služby a výroba produktů na zakázku
Standardy EV
Samozřejmostí je i výroba standardů pro charakterizaci EV. HansBioMed nabízí několik možností:
- Exozomy/malé EV (40-120 nm) - čištěné kombinací tangenciální průtokové filtrace (TFF) a velikostní vylučovací chromatografie (SEC)
- Mikrovezikuly/velké EV (150-1000 nm) - separované tangenciální průtokovou filtrací pomocí filtru TFF-MV a poté přečištěny pomocí SEC. EV jsou kvantifikovány a charakterizovány z hlediska celkového obsahu proteinů a exprese povrchových markerů (CD9, CD63, CD81)
- Fluorescenčně značené exozomy a mikrovezikuly – na vyžádání může HBM poskytnout také fluorescenčně značené standardy exozomů z lidských tělních tekutin nebo buněčných médií pro sledování EV v experimentech s fluorescenční mikroskopií.
Výhody:
- vysoce čisté a charakterizované EV
- snadná rekonstituce,
- snadná přeprava a skladování (+4 °C)
- dlouhodobá stabilita při skladování (36 měsíců)
- EV jsou na vyžádání k dispozici z velké banky buněčných linií (více než 100 buněčných linií).
Nástroje pro izolaci a purifikaci EV
HansaBioMed vyvinula a optimalizovala nástroje pro rychlou a účinnou izolaci EV pomocí různých přístupů:
PURE-EVs a PURE-EV-PLUS jsou kolony pro vylučovací chromatografii (SEC) druhé generace, vhodné pro izolaci vysoce čistých EV z tělních tekutin (tj. plazmy, séra a moči) a z médií buněčných kultur. Jedná se o rychlou 15 minutovou izolaci. Do kolonky se nalije vzorek, proteiny a další malé molekuly se zachytí v pórech částic kolonky a EV protečou kolonkou jen s minimální zádrží. Kolonky lze až pětkrát opakovaně použít.
EXO-Prep je jednostupňová metoda pro celkovou izolaci extracelulárních vezikul z tělních tekutin a z buněčných kondicionovaných médií pomocí chemické precipitace. Vzorek se na ledu smíchá se srážecím činidlem a po inkubace se vysrážené EV odstředí.
evGAG je rychlá purifikační metoda využívající interakci mezi srážecím roztokem a glykosaminoglykany (GAG) v EV. Jedná se o rychlý preanalytický test, který umožňuje rychlou izolaci EV z tělních tekutin.
Důležité je zkoumat i heterogenitu populací EV, protože různé vezikuly mohou hrát různou roli v patologických procesech, jako je rakovina nebo neurodegenerativní onemocnění. HansaBioMed nabízí předem potažená ELISA destičky a latexové nebo magnetické imuno kuličky pro záchyt a obohacení subpopulací EV.
Filtrace a koncentrace EV
Tangenciální průtoková filtrace (TFF) je rychlá a účinná metoda, která se obvykle používá pro separaci a čištění biomolekul. TFF lze také použít ke koncentraci a odsolování roztoků vzorků a ve spojení se SEC se stává novou technikou pro izolaci EV.
Nabízíme 3 typy filtrů a koncentrátor:
TFF-Easy je filtrační souprava pro koncentraci zředěných matric, jako jsou buněčná média a moč, před izolací EV. Jedná se o trubičku z dutého polysulfonového vlákna s definovanými póry. Tokem vzorku přes kolonku s membránou dochází ke koncentraci EV uvnitř. Filtrace trvá pouhých 5 minut a jednu TFF kolonku lze použít až dvacetkrát.
TFF-MV je filtrační souprava pro separaci velkých mikrovezikul (> 150 nm) z buněčných médií, tělních tekutin nebo preparátů EV. Využívá stejného principu jako TFF-Easy a filtrace trvá pouhých 5 minut. Kolonky lze opět opakovaně použít.
TFF-EV je filtrační souprava pro separaci malých EV (< 150 nm) z buněčných médií, tělních tekutin nebo preparátů EV. Využívá stejného principu jako TFF-Easy a filtrace trvá pouhých 5 minut. Kolonky lze opět opakovaně použít. V odkazu naleznete variantu pro velké i malé objemy.
EV-Spinner je ultrafiltrační koncentrátor pro koncentraci roztoků obsahujících EV, exozomy nebo nanočástice, pro koncentraci zředěných matric před izolací EV, pro odstranění malých molekul a nenavázaných barviv z roztoku obsahujícího EV a nanočástice, pro dialýzu EV a koncentraci suspenzí EV po izolaci pomocí SEC je možné použít ultrafiltraci pomocí koncentrátoru
Charakterizace EV
Výzkum EVs potřebuje spolehlivé, cenově dostupné a optimalizované nástroje pro kvantifikaci a charakterizaci vezikul v komplexních biologických vzorcích i v buněčných modelech.
HBM nabízí soupravy:
ExoTEST je souprava pro záchyt a kvantifikaci exozomů pomocí ELISA destiček.
Exo-FACS - pro kvantifikaci a charakterizaci markerů EV pomocí FACS ( z anglického - (Fluorescent Activated Cell Sorting, co je specializovaný typ průtokové cytometrie)
Enolase Activity Kit – umožňuje charakterizovat a ověřit funkčnost různých zdrojů EV pomocí stanovení jejich enolázové aktivity.
Izolace RNA a DNA z EV
Společnost HBM vyvinula optimalizovaná řešení pro účinnou izolaci vysoce kvalitní celkové RNA (miRNA a mRNA) z celkové nebo nádorově specifické subpopulace EV a také pro izolaci cirkulující a EV-asociované genomové DNA. V klinických podmínkách umožňují naše řešení ultra senzitivní detekci mutací a molekul RNA souvisejících s nádorem, což umožňuje novou generaci screeningových, monitorovacích a „stagingových“ testů.
RNA Basic Kit - sada umožňuje extrakci celkové RNA z exozomů předem izolovaných různými metodami (ultracentrifugace, chemické srážení, velikostní chromatografie atd.).
SeleCTEV - preanalytický test umožňuje selektivní purifikaci cirkulující volné DNA (cfDNA) a DNA z EV z plazmy. Izolace je založena na patentované peptidové afinitní metodě
SoRTEV - souprava umožňuje purifikaci RNA z nádorových EV z plazmy. Izolace je založena na imunoafinitní vazbě na kuličky potažené patentovanými protilátkami společnosti proti povrchovým antigenům exozomů. Představuje novou generaci diagnostických testů nádorů založených na RNA.
Polyklonální a monoklonální protilátky
Protilátky jsou základním nástrojem pro základní výzkum, vývoj diagnostických testů a terapie lidských onemocnění. Extracelulární vezikuly (EV), včetně exozomů, exprimují antigeny s 3D konformací a/nebo post translačními modifikacemi, které se často liší od buněčného protějšku. Z tohoto důvodu většina protilátek, které jsou v současné době na trhu k dispozici, nerozpoznává antigeny spojené s EV s dostatečnou citlivostí a specifičností. Ve spolupráci s firmou Exosomics Siena Spa ověřila společnost HBM seznam polyklonálních a monoklonálních protilátek proti běžným (CD63, CD81, ALIX) a specifickým (rakovina a neurodegenerativní onemocnění) markerům EV.
